美国衡健生物科技有限公司是东方基因在美国得克萨斯州的全资子公司。10月8日,美国FDA专题为衡健生物获得流感与新冠病毒联合家用检测试剂的De Novo在领英网等平台发布新闻公告。
FDA公告题为:FDA授权首个非紧急使用授权下的流感与新冠病毒联合家用检测试剂上市。
公告指出:美国食品药品监督管理局(FDA)正式授予Healgen Rapid Check新冠病毒/流感(A型及B型)抗原检测试剂的营销授权。该试剂为非处方药产品,无需医生处方即可使用,适用于有呼吸道症状的患者。借助鼻拭子轻松采样,用户在家就能自主进行新冠病毒与流感(A型及B型)的快速检测,仅需大约15分钟即可获取准确结果。
公告指出:这是首个通过传统上市前审查途径获得营销授权的OTC流感检测试剂,其上市不再依赖于紧急使用授权。目前市场上虽已有其他OTC流感/新冠病毒检测试剂,但它们均是基于紧急使用授权而推出的产品。公告指出:美国食品药品监督管理局器械与放射健康中心代理主任、医学博士米歇尔·塔弗(Michelle Tarver)表示:“现在,我们已经步入了今年的流感季,同时还需警惕新冠肺炎等呼吸道疾病的传播。因此,能够高效、准确地检测这些病原体对于我们的日常生活至关重要。本次授权无疑为有呼吸道症状的患者提供了更多便利,使他们在家中就能够轻松获取自身健康信息。我们将继续致力于推动家用检测试剂的开发与普及,以满足公众对于多种疾病检测的需求。”
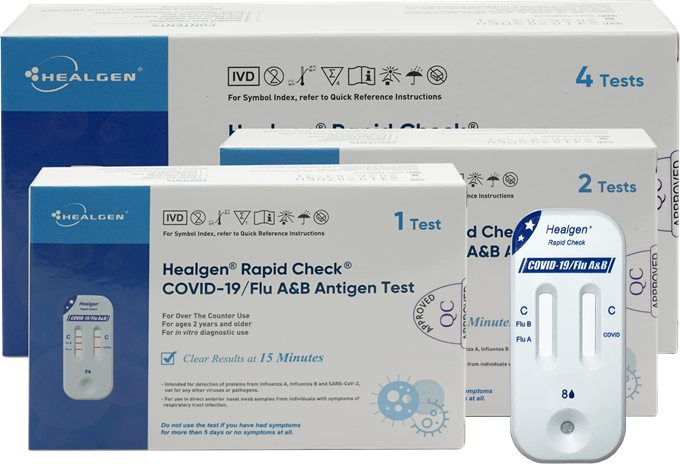
公告指出:该检测试剂适用于14岁及以上能自行采集并检测样本的用户,2岁以上14岁以下的儿童应在成人协助下完成样本采集与检测。美国FDA审核了一项针对表现出新冠病毒与流感症状和体征的患者的研究数据,结果表明,该检测试剂可准确鉴别出99%的SARS-CoV-2阴性样本与92%的阳性样本,99.9%的A型及B型流感阴性样本,而甲型流感和乙型流感阳性样本的比例分别为 92.5%和 90.5%。
建设产品合规认证堡垒
公告指出:该检测试剂的验证数据由独立测试评估计划(ITAP)收集,该计划隶属于美国国立卫生研究院(NIH)快速诊断加速(RADx®)技术项目,并与FDA紧密合作。ITAP自2021年启动以来,一直致力于加速测试评估流程,以助力FDA的监管审核,并向公众提供高质量、精确可靠的诊断检测试剂。公告说,需注意的是,与灵敏度较高的分子检测相比,所有快速抗原检测均存在假阴性结果的风险。若用户检测呈阴性但持续出现发热、咳嗽及/或呼吸急促等症状,可能仍感染SARS-CoV-2、流感或其他呼吸道疾病,并应立即寻求医疗专业人员的后续诊疗。SARS-CoV-2或流感检测呈阳性的患者应采取适当预防措施,避免病毒传播,并寻求医生或医疗专业人员的后续治疗。

公告还说,除本次授权外,FDA还设立了特殊控制标准,以明确标签及性能测试相关的要求。当满足这些特殊控制以及一般控制时,可为该类型检测试剂提供合理的安全性和有效性保证。此外,此举还开创了一个新的监管分类,这表明具有相同预期用途的后续同类设备可通过FDA更为简便的510(k)途径获得批准,即其他设备可通过证明与已上市设备的实质性等同来获得市场准入许可。
【关于De Novo】
美国FDA隶属于美国卫生与公共服务部,其职责是确保人类用药与兽药、人用疫苗和其他生物制品以及医疗器械的安全性、有效性与合规性,肩负着保护公众健康的重任。此外,该机构还负责保障美国食品、化妆品、膳食补充剂、辐射性电子产品的安全性,以及对烟草产品进行监管。
附FDA新闻稿中文翻译/原文链接:FDA Authorizes Marketing of First Home Flu and COVID-19 Combination Test Outsideof Emergency Use Authorities | FDA https://www.fda.gov/news-events/press-announcements/fda-authorizes-marketing-first-home-flu-and-covid-19-combination-test-outside-emergency-use